Ковалентная связь
Ионная связь- не единственный тип химической
связи. В молекуле хлора Cl2 (3s23p5) мы встречаемся с так называемой ковалентной
связью между атомами. В такой связи каждый из двух атомов делится с другим одним из своих внешних электронов. При этом оба приобретают восьмой электрон в свою
внешнюю оболочку и обретают устойчивую конфигурацию.
Каждую ковалентную связь удобно схематически представить палочкой (С_С) или в виде точки и крестика.

Рис 54. Схема
ковалентной
связи
Электроны, образующие общую пару, называются валентными. Образуя ковалентную связь, они занимают одну и ту же орбиталь, а их спины, согласно принципу Паули, направлены в противоположные стороны. Таким образом, орбитали атомов при ковалентной связи перекрываются между собой.
Электроны, образующие общую пару, называются валентными. Образуя ковалентную связь, они занимают одну
и ту же орбиталь, а их спины, согласно принципу
Паули, направлены в противоположные стороны. Таким образом,
орбитали атомов при ковалентной связи перекрываются
между собой.
Для того чтобы орбитали перекрывались, расстояние между атомами должно
быть очень маленьким. Этому препятствуют силы отталкивания между их ядрами. Но ковалентная
связьдостаточно сильна, чтобы удержать атомы в таком положении. Благодаря этому нелегко оторвать атомы с общей орбиталью
друг от друга.

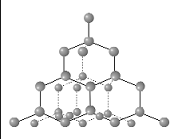
Рис 55. Структура алмаза
Ковалентная связь наиболее характерна для молекул, состоящих из одинаковых атомов (например, H2 или Cl2), либо каркасных структур (алмаз). Двойная, и, тем более, тройная ковалентные
связи прочнее обычной.
Ионная и ковалентная связи являются двумя предельными случаями множества
реально существующих химических связей, которые в действительности имеют промежуточный характер. Однако можно утверждать,
что некоторые соединения являются преимущественно
ионными, а некоторые преимущественно ковалентными.
Проводя шутливую аналогию, можно заметить, что стремление атомов
отнять, отдать или поделить между собой электроны, чтобы достичь электронной устойчивости,
сильно напоминает социальное поведение людей, манипулирующих деньгами для достижения своего комфорта (морального
либо материального). Есть “атомы–меценаты”, вступающие в химическую связь путем
безвозмездной отдачи “лишних” электронов. В противоположность
им существуют и настоящие “рэкетиры”, которые
так и норовят оторвать какой-нибудь электрон у зазевавшегося соседа.
Но есть и “добропорядочные граждане”,
Впрочем, стоит заметить, что поведение отдельных атомов во многом зависит “от обстоятельств” – в разных реакциях одни и те
же вещества (как и люди) могут вести себя совершенно по-разному.