Ионная связь
Ионная связь представляет собой
электрическое притяжение между противоположно заряженными ионами (частицами,несущими
электрический заряд).
"Ion" в переводе с греческого, означает
"идущий"-это подчеркивает, что ионы движутся в электрическом поле.
Согласно гипотезам Планка и Бора,
энергия каждого электрона в атоме квантована и принимает лишь определенные значения, соответствующие конкретным
энергетическим уровням (орбитам). Электроны могут переходить с одного уровня
на другой, поглощая или излучая фотоны. Поглотив фотон, элект- рон переходит
на более высокую орбиту, а сила, связывающая его с ядром, уменьшается.
Если электрону удается полностью
“освободиться” от сил притяжения ядра и покинуть атом, то происходит ионизация атома. Атом превращается в положительный ион, именуемый катионом и обозначаемый знаком “плюс”.
Na+, Аg+ - катионы натрия и серебра
Если же атом, наоборот, принимает
в себя дополнительные электроны, то их избыток превращает его в отрицательный ион – анион, который изображается с “минусом”, например:
Cl¯,O¯ - анионы хлора и кислорода
Напомним, что химическая связь
объясняется стремлением атомов приобрести устойчивую электронную конфигурацию, подобную
конфигурации “ближайшего” к ним инертного газа. Рассмотрим некоторую последовательность элементов
в таблице Менделеева, среди которых имеется неон (1s12s22p6).
В
скобках рядом с символом элемента указано число электронов в K-, L- и М-оболочках.
F(2.7); Ne(2.8); Na (2.8.1)
Атом натрия может приобрести
устойчивую электронную конфигурацию неона, избавившись от одного электрона.
![]()
Образовавшаяся частица – положительно
заряженный ион натрия.
У фтора на один электрон меньше, чем у неона. Следовательно,
если фтор присоединит один электрон (например, от атома натрия), он приобретает заполненную
внешнюю оболочку из восьми электронов:
![]()
Между полученными частицами –
анионом фтора и катионом натрия-будет действовать сила электростатического притяжения,
связывающая их между собой. Это и называется ионной химической связью.
Одно из свойств ионных соединений-способность
образовывать кристаллическую решетку, в узлах которой расположены положительные и отрицательные ионы. Типичный представитель
вещества с ионной связью – всем известная по варенная соль. Ее формула - NaCl.
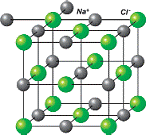
Рис 51. Модель
кристаллической решетки
хлорида натрия
Большинство ионных соединений
легко разрушаются под внешним воздействием или в химических реакциях. На рисунке 52 показано,
что происходит, если на ионный кристалл действует деформирующая сила. Не-большие
сдвиги в кристаллической решетке сближают одинаково заряженные ионы. При этом силы
отталкивания между одноименными зарядами создают трещины в кристалле.
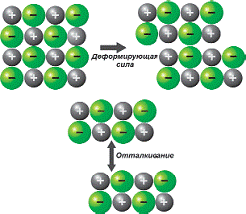
Рис 52.. Схема поведения кристаллической
решетки
NaCl под действием деформирующей
силы
Рисунок 53 хорошо иллюстрирует,
что происходит с кристаллами соли, когда им приходится иметь дело с молекулами воды. Атомы, из которых
состоит вода имеют различный заряд, (кислород больше и тянет электронное “одеяло”
на себя, что делает его отрицательнее, чем водород). Поэтому атомы кислорода притягивают
положительно заряженные катионы натрия, а атомы водорода – анионы хлора,растаскивая
кристаллическую решетку NaCl.
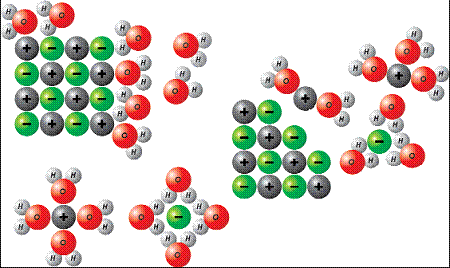
Рис 53. Иллюстрация процесса растворения
соли вводе