Уравнение Шредингера и Периодическая
система элементов Менделеева
Многообразие нашего мира объясняется огромным разнообразием элементов, существующих во Вселенной. В настоящее время науке известно
более 110 элементов с уникальными физико_химическими
свойствами.
Мы знаем, что атом любого вещества состоит из положительно заряженного
ядра, окруженного облаком электронов. Ядро, в
свою очередь, состоит из некоторого количества протонов, заряженных положительно,
и нейтронов, не имеющих никакого заряда. Атомы стабильны потому, что в своем основном состоянии они энергетически нейтральны, то есть положительный заряд
ядра полностью скомпенсирован суммарным зарядом электронов (число протонов в ядре
атома равно числу электронов на его орбиталях).
Ученые всегда стремились упорядочить все разнообразные элементы в некую единую логическую схему. Самой удачной попыткой сделать это оказался принцип, предложенный в 1869 году русским ученым Д.И. Менделеевым, который лег в основу современной Периодической системы элементов.
В таблице Менделеева элементы расположены в порядке возрастания их атомных номеров (числа протонов в ядре). Например,
атомный номер водорода равен единице. Это говорит о том, что ядро атома водорода состоит из одного протона, вокруг которого вращается единственный электрон.
Элементы распределены по горизонтальным рядам, называемым периодами, и вертикальным столбцам, называемым группами. Такое распределение основывается на некоторой общности физико_химических свойств элементов, которые периодически
изменяются в соответствии с их атомным номером.
Например, все элементы первой группы (кроме водорода) являются щелочными металлами, а все элементы восьмой группы представляют собой благородные
газы.
Все это здорово, но при чем же здесь уравнение Шредингера? Мы помним, что согласно принципу Паули, электронная оболочка атома не может одновременно содержать два электрона в одном
и том же состоянии. А поскольку число электронов в некоторых атомах достигает десятков и даже сотен, то возни-кает естественный вопрос: как же они все там расположены?
Решение волнового уравнения Шредингера позволило вычислить четыре параметра, которых достаточно, чтобы полностью охарактеризовать состояние
любого отдельно взятого электрона. Эти параметры получили название
“четыре квантовых числа”.
Полученная квантовая четверка – своего рода “паспорт”,
однозначно
идентифицирующий каждый электрон в атоме.

Чем больше число n, тем дальше электрон отстоит от ядра и тем выше
его энергия. Выделяют четыре энергетических оболочки:
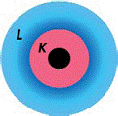
Рис 41. Схема атома с
двумя энергетическими
оболочками
Но одного деления на оболочки для полного описания состояния электрона
недостаточно. Дело в том, что каждая энергетическая оболочка атома может “вмещать в себя” разное количество электронов.
Понятно, что для того, чтобы обеспечить их уникальность
(согласно принципу Паули), каждая оболочка должна разбиваться
еще на несколько подоболочек, получивших название орбиталей.

Решение уравнения Шредингера позволило вычислить формы всех существующих видов электронных орбиталей. Их всего четыре: s*,
p*, d* и f_орбитали. На рисунке изображен вид s_, p_ и d_орбиталей. S_орбиталь имеет сферическую форму, p_ орбиталь – форму гантелей, d_орбиталь похожа на трехмерный четырехлепестковый цветок.
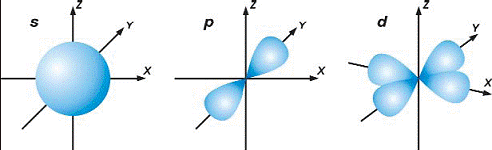
Рис 42. Форма s*, p* и d* орбиталей
Каждому типу орбитали соответствует определенная энергия электрона.
При переходе с одной орбитали на другую электрон испускает излучение, характерное
для соответствующего типа линий в атомном спектре, откуда,
собственно, и произошло их название:
s_орбиталь соответствует “резкой”
(sharp) s_линии атомного спектра;
p_орбиталь соответствует “главной”
(principal) p_линии;
d_орбиталь соответствует “диффузной”
(diffuse) d_линии;
f_орбиталь соответствует “фундаментальной”
(fundamental)f*линии;
Энергетические уровни оболочек содержат в себе разное количество орбиталей. На рисунке показано относительное расположение энергетических уровней орбиталей, принадле жащих первым четырем электронным оболочкам:
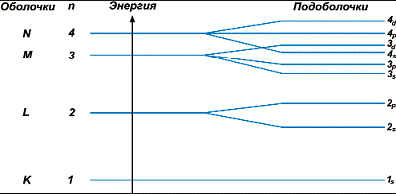
Рис 43. Порядок расположения
атомных орбиталей и оболочек
Так, первая К_оболочка содержит только одну s*орбиталь. Следовательно, на первом энергетическом уровне может “жить” либо один, либо два электрона. Вторая оболочка включает не
только s*, но и 3 p*орбитали. Здесь обитают уже 2+6=8 электронов и т.д. Обратите внимание на особенность 4s_подоболочки:
ее энергетический уровень расположен чуть ниже 3d_подоболочки.

Электрон – это не только отрицательно заряженная частица, но еще
и миниатюрный магнит, подобный стрелке компаса с северным и южным полюсами.
Электрон нельзя размагнитить, но зато можно
поворачивать в пространстве, воздействуя на него внешним электромагнитным полем.
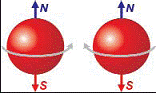
Рис 44. Магнитные полюсы электрона
Число m также показывает максимально возможное
число орбиталей для каждойоболочки l.
Всего на
оболочке может быть:
__одна s–орбиталь;
__три p–орбитали;
__пять d– орбиталей;
__семь f– орбиталей.
Давайте теперь пристальнее посмотрим на один отдельно взятый электрон. Он, подобно планете Солнечной системы, вращается не только вокруг положительно заряженного ядра, но и вокруг собственной оси. Поэтому одной из важнейших характеристик
при описании электрона является его спиновое квантовое
число.

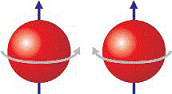
Рис 50. Спин электрона. Пару электронов
с противоположными спинами изображают cтрелками ![]()
Итак, принимая во внимание приведенные выше сведения, принцип
запрета
Паули можно переписать следующим образом:
Никакие два электрона в атоме
не могут иметь одинаковые наборы
четырех квантовых чисел.
Электронная конфигурация элемента -это запись распределения электронов в атоме по оболочкам и орбиталям.
Она обычно записывается для атомов в основном
состоянии соглас но следующим правилам:
1.
Электроны заполняют орбитали
последовательно, от меньшего энергетического уровня к большему. Низшие по энергии орбитали всегда заполняются первыми.
Например:
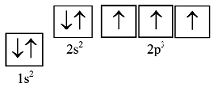
Водород, атомный номер =1, число электронов = 1
Этот единственный в атоме водорода электрон должен занимать s_орбиталь
К_оболочки, поскольку из всех возможных орбиталей она имеет самую низкую энергию. Электрон на этой орбитали называется 1s
электрон.
Следовательно, электронная конфигурация водорода в основном состоянии:
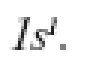
2.
На любой орбитали может находиться
не более двух электронов, и то лишь в том
случае, если они имеют противо положные спины.
Например:
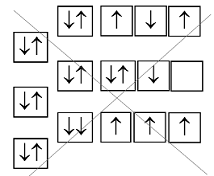
Литий, атомный номер =3, число электронов
= 3
Орбиталь с самой низкой энергией –
это 1s_орбиталь. Она может принять на себя только два электрона
с неодинаковыми спинами. Схематически это записывается
так: ![]()
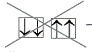 запрещенное расположение спинов.
запрещенное расположение спинов.
Третий электрон в атоме лития должен
занимать орбиталь,следующую по энергии за самой низкой орбиталью,
т.е. 2s_орбиталь. Таким образом, литий имеет электронную конфигурацию: 1s22s1.
3. Заполнение орбиталей одной подоболочки начинается одиночными электронами с параллельными (одинаковыми по знаку) спинами, и лишь после того, как одиночные электроны займут все орбитали, может происходить окончательное заполнение орбиталей
парами электронов с противоположными
спинами.
Например:
Азот, атомный номер =7, число электронов = 7
Азот имеет электронную конфигурацию 1s22s22p3. Три электрона, находящиеся на 2p_подоболочке, должны
располагаться поодиночке на каждой из трех
2p_орбиталей. При этом все три
электрона должны иметь параллельные спины.
|
Разрешенная
конфигурация электронов |
Три неразрешенные
конфигурации электронов |
Современная наука считает все электроны стандартными, поэтому если поменять два любых электрона местами, конфигурация системы
не изменится. В таблице представлены электронные конфигурации элементов с атомными
номерами от 1 до 20:

Табл 4. Электронные конфигурации
первых 20_ти элементов Периодической системы
Из таблицы видно, что электронные конфигурации элементов отличаются
периодичностью, что и отображено в таблице Менделеева. Например, все элементы одного
периода имеют одинаковый электронный остов (внутренние
электронные оболочки) и отличаются лишь количеством электронов, находя_
щихся на
подоболочках с самой высокой энергией.

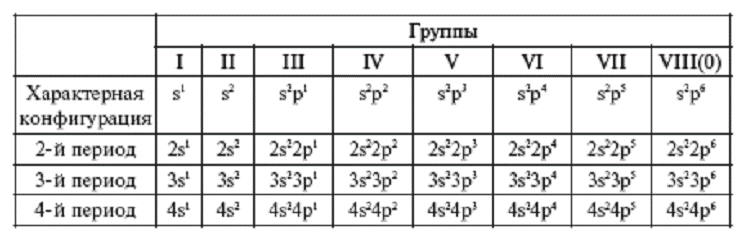
Табл 5. Электронная конфигурация
высшей по энергии подооболочки у элементов различных групп
Электронная конфигурация элементов VIII группы называется устойчивой, поскольку при этом внешняя оболочка их атомов заполнена полностью. Элементы этой группы получили название “инертных” или “благородных” газов, поскольку из-за своей устойчивой электронной конфигурации при обычных
условиях
они практически не образуют химических соединений. Подробнее о механизме образования
химических связей можно прочесть в главе, посвященной
нанохимии.