Ван-дер-ваальсовы силы
Кроме рассмотренных типов химической связи говорят также о сравнительно слабых силах Ван_дер_Ваальса. В 1873 году этот
человек выдвинул предпо-ложение о существовании сил межмолекулярного
притяжения, подобных тем, что существуют в связях между атомами. В дальнейшем гипотеза подт-вердилась были открыты различные типы межмолекулярного взаимодействия,
где наиболее распространено так называемое
диполь-дипольное притяжение.
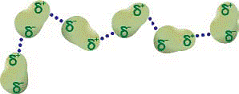
Рис 8. Схема диполь_дипольного притяжения
Некоторые молекулы (преимущественно с ковалентными связями) обладают так называемым дипольным моментом. Его суть в том, что в одной части молекулы
“скапливается” больше электронов, чем в другой. Это приводит
к
возникновению разности потенциалов на ее концах. Сила притяжения
между раз-
личными
зарядами связывает молекулы между собой, как показано на рисунке.
В настоящий
момент термин “Ван_дер_ваальсовы силы” распространяется
на все слабые межмолекулярные силы, кроме водородной
связи.